INNOVATIV + TRADITIONSBEWUSST
EINFACH FRANZISKUS

MENSCHLICH + MODERN
EINFACH FRANZISKUS

EINZIGARTIG + VIELFÄLTIG
EINFACH FRANZISKUS
- 1
- 2
- 3
- Startseite
- Unsere Kompetenzen
- Kardiologie, Angiologie
- Herzkatheterlabor
- Innere Medizin III
- Anmeldung & Sprechstunden
- Ärzteteam
- Pflegeteam
- Herzkatheterlabor
- Department Elektrophysiologie
- Sektion Interventionelle Kardiologie
- Sektion Strukturelle Herzerkrankungen und Interventionelle Herzklappentherapie
- Sektion Devicetherapie
- Sektion Kardiale Bildgebung
- Kardiologische Funktionsabteilung
- Tagesklinik
- Weiterbildung
Herzkatheterlabor (=HKL)
Unsere kardiologische Abteilung verfügt über zwei modern ausgestattete Herzkatheterlabore sowie einen interdisziplinär genutzten Hybrid-OP.
Das HKL I ist mit einer Katheteranlage der neusten Generation ausgestattet. Hiermit ist es möglich, die Strahlenbelastung für den Patienten auf ein Minimum zu reduzieren. Im Frühjahr 2017 wurde zudem das ebenfalls hochmoderne HKL II in Betrieb genommen. Die gesamten Räumlichkeiten der Labore wurden modernisiert und zeichnen sich nun durch viel Platz, helle Farben und modernste Überwachungsgeräte aus.
Jährlich werden ca. 2000 Patienten in unseren Herzkatheterlaboren behandelt. Bei mehr als 800 Patienten pro Jahr führen wir eine Intervention an den Koronargefäßen (Herzkranzgefäße) durch. Die Indikation zur Herzkatheteruntersuchung wird anhand der Symptomatik des Patienten sowie entsprechender Vordiagnostik ( EKG/ Belastungs-EKG/Myokardszintigraphie/ Kardio-CT) gestellt. Das diagnostische beziehungsweise therapeutische Spektrum des Herzkatheterlabors umfasst folgende Eingriffe:
Mitralklappentherapie
Mitralklappeninsuffizienz
Als Mitralklappeninsuffizienz bezeichnet man die „Undichtigkeit“ der Mitralklappe bedingt durch einen gestörten Klappenschluss. Sie ist der zweithäufigste Herzklappenfehler in Europa und oft über die Jahre stetig fortschreitend. Die Ursache dafür kann ein primärer Schaden an der Klappe selbst (Entzündung, Alterung, angeborene Verdickung) oder eine Erweiterung der linken Herzkammern sein.
Bei einer Mitralklappeninsuffizienz kommt es zu einem Rückfluss des Bluts aus der linken Herzkammer in den linken Vorhof. Dies führt zu einer vermehrten Blutfülle der linken Herzkammern und der Lungengefäße. Patienten mit einer leichten Form haben oftmals keine Beschwerden. Eine schwere Mitralklappeninsuffizienz macht sich häufig durch Symptome wie Luftnot, Leistungsschwäche oder auch Herzrhythmusstörungen bemerkbar.
Bei schweren Formen hat sich die herzchirurgische Operation seit vielen Jahren als Therapieverfahren etabliert. Dabei wird die Klappe rekonstruiert („repariert“) oder durch eine künstliche Herzklappe ersetzt. Zum Teil wird gleichzeitig eine Bypassoperation der Herzkranzgefäße oder einer Raffung der Trikuspidalklappe durchgeführt.
Allerdings besteht bei einem offenen herzchirurgischen Eingriff insbesondere bei älteren Patienten mit bedeutenden Vorerkrankungen ein stark erhöhtes Operationsrisiko. Für diese Patienten kann das MitraClipÔ-Verfahren eine Alternative zur Operation sein.
Mitraclip® / PASCAL® -Verfahren
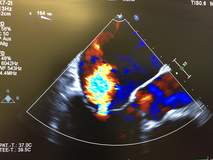
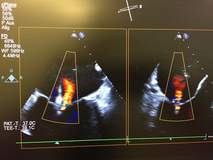
Beim MitraClip®/PASCAL® wird über die Leistenvene und über die Vorhofscheidewand ein spezielles Einführbesteck in den linken Vorhof gebracht. Darüber wird dann der Clip am Ort der größten Klappenundichtigkeit positioniert und geschlossen. Es entsteht ein Steg zwischen den beiden Klappensegeln, die zusätzlich gerafft werden. In den meisten Fällen wird dadurch die Klappenundichtigkeit und damit die Herzschwäche deutlich verbessert. Gelegentlich müssen für einen guten Erfolg zwei oder mehr Clips eingesetzt werden. Der Eingriff wird am schlagenden Herzen in Vollnarkose durchgeführt und dauert je nach Komplexität des Klappenschadens zwischen 45 Minuten und 2 Stunden.Die Clip-Platzierung wird per Röntgen-Durchleuchtung und Ultraschall über die Speiseröhre (transösophagealen Herzultraschall) gesteuert. Ein Kontrastmittel muss dabei nicht gegeben werden.
Herzteam-Visite
Für alle Patienten mit einer bedeutenden Mitralinsuffizienz findet am St. Franziskus Hospital eine fachübergreifende Herzteam-Visite statt, bei der die für den Patienten beste Therapie festgelegt wird.
Trikuspidalklappentherapie
Trikuspidalklappeninsuffizienz
Die "Undichtigkeit“ der Trikuspidalklappe ist fast genauso häufig wie die der Mitralklappe. Ursächlich sind bei der Trikuspidalklappe aber noch häufiger funktionelle Veränderungen. Das bedeutet, dass die Klappenstrukturen selbst intakt sind, die Klappe oder der Halteapparat der Klappe aber meist durch Vergrösserungen der rechten Herzvorkammer oder der rechten Herzhauptkammer auseinander gezogen werden und dadurch nicht mehr schliessen. Ursächlich für diese Vergrösserungen des rechten Herzens sind oft langjährige Herzschwächeerkrankungen des linken Herzens oder Hochdruckerkrankungen der Lungenschlagadern, die sekundär zu einer Belastung des rechten Herzens führen. Diese Patienten sind daher schwer krank und aufgrund des hohen Risikos praktisch nie für eine chirurgische Behandlung der Trikuspidalklappe zugänglich.
PASCAL-Verfahren
Durch die Entwicklung kathetergestützer Reparaturverfahren wurde erstmals eine Therapiemöglichkeit für diese Patienten geschaffen. Ähnlich wie beim Mitralklappenclippingverfahren wird beim PASCAL-Verfahren der Trikuspidalklappe das Device über die Leistenvene in den rechten Vorhof vorgebracht. Der PASCAL-Device wird dann am Ort der größten Undichtigkeit positioniert und die Segel der Trikuspidalklappe gefasst und die Klappenundichtigkeit dadurch reduziert. Anders als bei der Mitralklappe hat die Trikuspidalklappe drei Segel, wodurch der Eingriff häufig komplexer und durchaus mit zwei Pascal-Devices versorgt werden muss. Dieser Eingriff erfolgt in Vollnarkose.
Carillon Mitral Contour-System
Das Carillon® Mitral Contour System® ist ein neues perkutanes indirektes Anuloplastie-System für die Mitralklappe, das über einen venösen Zugang über die Halsvene (Vena jugularis) vorgebracht wird. Die implantierbare Vorrichtung besteht aus einem proximalen und einem distalen Anker, die über ein formgebendes Band miteinander verbunden sind. Die Vorrichtung macht sich die Nähe des Koronarsinus zum Mitralklappenapparat zunutze und ist dafür konzipiert, nach dem Einsetzen die Überdehnung des Klappenrings durch die eingesetzte Spange im Koronarsinus zu verringern und so die funktionelle Mitralklappeninsuffizienz zu reduzieren.
Mit dieser Methode können ebenfalls Patienten mit Herzinsuffizienz und begleitender Mitralinsuffizienz im Rahmen eines minimalinvasiven Verfahrens behandelt werden. Die klinischen Daten zeigen, dass das Carillon-Implantat mit einer Verringerung der Mitralinsuffizienz und einer Verbesserung der Leistungsfähigkeit und der Lebensqualität einhergeht. Nach dem Eingriff kommen die Patienten, meist bereits in wachem Zustand, für eine Nacht auf eine Überwachungsstation. Der gesamte Kliniksaufenthalt liegt bei unkompliziertem Verlauf ebenfalls zwischen fünf und sieben Tagen.
TASH: Alkoholablation bei hypertroph-obstruktiver Kardiomyopathie (HOCM)
Bei der hypertroph-obstruktiven Kardiomyopathie (HOCM) ist die Herzscheidewand verdickt, was zu einer Behinderung des Blutausstroms aus der linken Herzkammer führt. Eine sehr effektive Behandlungsform der HOCM stellt die kathetergeführte Septalastablation dar. Hierbei wird gezielt ein künstlicher Herzinfarkt im Bereich des verdickten Herzmuskels gesetzt, um die Einengung des Ausflusstraktes durch die Muskelverdickung zu reduzieren oder gar zu beseitigen. Der Eingriff erfolgt mittels Herzkatheter in lokaler Betäubung und wird durch eine transthorakale Herzultraschalluntersuchung kontrolliert. Die Ablation erfolgt durch die lokale Injektion von Alkohol (Alkoholablation, sog. TASH). Das Zielgefäß – ein kleiner Seitenast der linken Herzkranzarterie, welcher die Herzmuskulatur im Bereich des linksventriklären Ausflusstraktes versorgt (sog. Septalast) – wird mittels eines feinen Drahtes sondiert und gezielt mit einem Ballon verschlossen. Über diesen Ballon wird Alkohol injiziert, um den Herzmuskel zu veröden. Nach dem Eingriff werden die Patienten für 24 Stunden auf unserer Intensivstation überwacht und anschließend auf die Station verlegt. Es erfolgt durchgängig eine telemetrische Überwachung des Herzrhythmus, um auf möglicherweise im Rahmen des Eingriffs auftretende Herzrhythmusstörungen sofort reagieren zu können. Vor Entlassung des Patienten wird erneut eine transthorakale Ultraschallkontrolle durchgeführt, um den Therapieerfolg kontrollieren zu können, u.a. durch erneute Messung des Druckgradienten in der linken Herzkammer.
LAA-Occluder
Mehr als 90% der Gerinnsel im Herzen finden sich beim Vorhofflimmern im sogenannten linken Vorhofohr (LAA), einem sehr variabel geformten Anhängsel des linken Vorhofs. Dieses kann mithilfe eines sogenannten Vorhofohroccluders verschlossen werden. Der Occluder ist ein kleines Schirmchen, daß nach transseptaler Punktion (Vorbringen einer Schleuse vom rechten in den linken Vorhof) im Vorhofohr entfaltet wird und so das Vorhofohr abdichtet. Nach einer Einheilungszeit von ca 3-6 Monaten, in der die Oberfäche des Occluders mit Endothel (Gefäßinnenhaut) überzogen wird, kann bei gutem Sitz des Devices bis auf eine ASS 100-Therapie jegliche Form der Blutverdünnung unterlassen werden mit einem verbleibenden Schlaganfallrisiko <1% pro Jahr (ähnlich oder geringer dem unter gut eingestellter Marcumartherapie).
PFO-Verschluss
PFO ist die Abkürzung für "persistierendes Foramen ovale" und bezeichnet eine dauerhaft bestehende Öffnung in der Herzscheidewand, die den rechten und linken Herzvorhof voneinander trennt. Meist hat sich ein Teil der Trennwand im Mutterleib nicht oder nur unzureichend ausgebildet. Sind die Öffnungen zu groß oder sind mehrere Öffnungen vorhanden, gerät bei jedem Pumpvorgang des Herzens ein Teil des Blutes (Shunt) in den falschen Vorhof und kann so zu Belastungen der angrenzenden Strukturen führen.
Durch das Loch können zusätzlich kleine Gerinnsel, die sonst in der Lunge abgefangen und aufgelöst würden, direkt in Körperkreislauf gelangen. Diese Gerinnsel verstopfen kleine Arterien im Gehirn und lösen so Schlaganfälle aus.
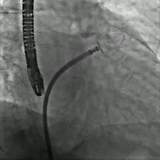
Um bei Patienten nach kryptogenem Schlaganfall ein erneutes neurologisches Ereignis zu vermeiden, bietet sich ein interventioneller PFO Verschluss an. Dabei wird über eine Punktion der Leiste die Öffnung mit einer Doppelschirmprothese verschlossen, die zusätzlich durch einen kleinen Anker an der Herzscheidewand gehalten wird. Die Vorgehensweise bei einem PFO-Verschluss ähnelt der einer Herzkatheteruntersuchung: Das gefaltete Schirmchen mit dem daran befestigten Anker wird über eine Vene mit einem Katheter bis zur Öffnung vorgeschoben. Zuerst wird der Katheter durch die Herzscheidewandöffnung geführt, damit der Anker auf der anderen Seite befestigt werden kann. Anschließend wird der Katheter zurückgezogen. Bei diesem Manöver entfaltet sich das Schirmchen über dem Loch und dichtet die Öffnung ab. Die Platzierung des Ankers und des Schirmchens findet unter Röntgendurchleuchtung und Herzultraschallkontrolle statt und dauert ca. 30 Minuten.
Koronarangiographie/Koronarintervention
Die Koronarangiographie wird bei Patienten mit Verdacht auf eine koronare Herzerkrankung, im Notfall bei Patienten mit einem Herzinfarkt aber auch bei Patienten mit Herzklappenerkrankungen eingesetzt.
Die Herzkatheteruntersuchung wird in unserer Abteilung in der Regel nach örtlicher Betäubung über eine Arterie am Handgelenk (Pulsschlagader) in selteneren Fällen auch über die Leiste durchgeführt. Der Zugang am Handgelenk kann nach der Untersuchung mit einem kleinen Druckverband versorgt werden. Lange Liegezeiten nach dem Herzkatheter können somit in der Regel vermieden werden.
Über den Zugang am Handgelenk oder in der Leiste kann ein dünner Katheter zum Herzen vorgeschoben werden. Hierüber kann eine geringe Menge Kontrastmittel in die Herzkranzgefäße injiziert werden und mit Hilfe von Röntgenstrahlung ein Bild von den Herzkranzgefäßen erzeugt werden.
Besteht eine Engstelle (Stenose) oder ein Verschluss eines Herzkranzgefäßes, kann das betreffende Gefäß durch einen Ballon wieder erweitert werden. In einem zweiten Schritt wird dann häufig eine Gefäßstütze (Stent) in das Gefäß eingebracht, um dieses auch langfristig offen zu halten.
Intrakoronare Druckdrahtmessung
In manchen Fällen ist es nicht eindeutig, ob eine Verengung eines Herzkranzgefäßes behandelt werden muss. In solchen Fällen kann mittels der sogenannten Druckdrahtmessung eine Quantifizierung der Verengung durchgeführt werden.
Bei dieser Messung kann mittels einer speziellen Kathetertechnik der Blutdruck innerhalb des Herzkranzgefäßes mit dem Blutdruck in der Aorta (Körperschlagader) verglichen werden. An den daraus ermittelten Werten kann individuell für den Patienten überprüft werden, ob eine Engstelle relevant ist und so wenn nötig, weitere therapeutische Schritte eingeleitet werden oder auch unterlassen werden.
Optische Kohärenztomographie (OCT)
Mittels der neuen intrakoronaren Bildgebungstechnik optische Kohärenztomographie (OCT) wird die Darstellung von Gefäßwandveränderungen (Ablagerungen, Gerinnsel oder Einrisse der Gefäßinnenschicht) und die Beurteilung des Gefäßlumens in höchster Bildqualität ermöglicht. Daneben können Gefäßerkrankungen bereits im Frühstadium anhand von Fett- oder Kalkablagerungen, sowie Verdickung einzelner Wandschichten nachgewiesen und ggf. bereits frühzeitig medikamentös behandelt werden. Insbesondere diese Frühveränderungen sind häufig mit der normalen Herzkatheteruntersuchung allein nicht erkennbar. Bei komplexen Koronareingriffen kann die genaue Beurteilung der Größe, Lage und Positionierung eines Koronarstents mittels OCT erreicht werden. Dadurch lässt sich der Erfolg einer Ballonerweiterung oder das Einsetzen eines Stents im Herzkatheter für den Patienten völlig schmerzfrei und direkt in Echtzeit überwachen.
Rotablation
Bei der Rotablation handelt es sich um ein Verfahren, welches bei Patienten mit stark verkalkten Engstellen zum Einsatz kommt. Hierbei wird ein diamantbesetzter Mikrobohrer in die Gefäße eingebracht, um den Kalk aus den Gefäßen abzutragen. Der Kalk wird somit in feinste Mikropartikel zerkleinert, so dass diese ohne Hindernisse die Gefäße passieren können und vom Körper aufgenommen werden. Anschließend wird die verbliebene Engstelle mit einem Ballon aufgedehnt und mit einem Stent versorgt.
Rechtsherzkatheter
Der Rechtsherzkatheter ist eine spezielle, invasive Untersuchung des rechten Herzen und dient vor allem der Messung der Hämodynamik. Darüber hinaus kann man die Lungengefäße beurteilen und so eine pulmonale Hypertonie (Lungenhochdruck) diagnostizieren. Beim Rechtsherzkatheter wird unter Röntgenkontrolle ein Katheter über ein venöses Gefäß in der Leiste in die rechte Herzhälfte (rechter Vorhof/ rechte Kammer) und weiter bis in die Lungengefäße vorgeschoben. Anschließend können verschiedene Messungen (Druckwerte in den Lungengefäßen, rechter Kammer, rechter Vorhof, Messung der Herzzeitvolumen) vorgenommen werden.
Impella-Mikroaxialpumpe
Eine zeitweise mechanische Unterstützung des linken Ventrikels durch perkutane Pumpensysteme kann bei der Behandlung verschiedener kardiologischer Krankheitsbilder von Nutzen sein. Hierzu zählen das akute und das chronische Herzversagen, bei dem es das geschädigte Herz über eine gewisse Zeit zu entlasten gilt, bis es sich erholt hat beziehungsweise eine weitere Therapie (dauerhaftes Unterstützungssystem wie „Kunstherz“) oder eine Herztransplantation möglich sind. Darüber hinaus wird die Mikroaxialpumpe Impella (2,5 oder CP) perkutan über eine Femoralarterie prophylaktisch bei der perkutanen Koronarintervention (PCI) von Hochrisikopatienten mit komplexer koronarer Herzkrankheit oder notfallmäßig im therapierefraktären kardiogenen Schock nach akutem Myokardinfarkt eingesetzt.
Cardio-CT (in Zusammenarbeit mit der Radiologischen Klinik)
In dieser Mehrschicht-CT-Untersuchung besteht die Möglichkeit, auf röntgenologischem Weg die Herzkranzgefäße ohne Durchführung einer Herzkatheteruntersuchung darzustellen.
Cardio-MRT (Magnetresonanztomografie) des Herzens
Diese Methode kommt ohne Strahlenbelastung aus. Durchgeführt wird diese Untersuchung bei strukturellen Herzmuskelerkrankungen, zur Quantifizierung von Herzklappenfehlern, Tumordiagnostik des Herzens, Entdeckung von Narben der Herzmuskulatur.
CS-Reducer
Bei Patienten mit therapierefraktärer Angina Pectoris ohne sinnvollen kathetertechnischen oder operativen Ansatz kann ein spezieller Stent (Coronary Sinus Reducer) über eine Halsvene im Sinus coronarius platziert werden. Der entstehende erhöhte venöse Druck führt zu einer Umverteilung des Blutes in vormals schlecht durchblutete ("ischämische") Herzmuskelbereiche und lindert die Angina pectoris-Beschwerden deutlich.
Device-Therapie
Implantierbarer Ereignisrecorder
Ereignisrekorder sind kleine Dauer-EKG´s (Stickgröße), die unter die Haut gesetzt werden und bis zu drei Jahre den Herzrhythmus überwachen können.
Sie werden eingesetzt bei seltener Bewusstlosigkeit (Synkopen), wenn andere diagnostische Mittel (wie z.B. LZ-EKG´s, 7-Tage-Recorder) keine Klärung der Ursache erbringen. Ein anderes Anwendungsgebiet sind unklare (kryptogene) Schlaganfälle, bei denen ein Vorhofflimmern als Ursache vermutet wird, das aber bisher nicht nachgewiesen werden konnte. Wird dann in der Folge Vorhofflimmern oder Vorhofflattern diagnostiziert, besteht die klare Notwendigkeit einer Blutverdünnung, um einen erneuten Schlaganfall zu vermeiden.
Auch zum Rhythmusmonitoring nach einer Ablation von Vorhofflimmern kommt ein Eventrecorder in Frage, um sicher eine Arrhythmiefreiheit nachweisen zu können.
Operation und Nachsorge: Nach einer örtlichen Betäubung wird ein kleiner Hautschnitt links neben dem Brustbein gesetzt und der Ereignisrecorder unter die Haut eingeschoben. Anschließend wird die Haut mit einem Faden vernäht. Der Eingriff dauert ca. zehn Minuten. Je nach benutzten Faden muss dieser zehn Tage nach der OP durch den Hausarzt entfernt werden.
In der Regel erfolgt die erste Geräte-Kontrolle nach ca. vier bis sechs Wochen, danach alle drei bis sechs Monate beim niedergelassenen Kardiologen.
Tritt ein erneutes klinisches Ereignis (Bewusstlosigkeit, Herzrasen) auf, sollte eine umgehende Abfrage zur Klärung der Ursache erfolgen.
Herzschrittmacher
Ist die Funktion des natürlichen Taktgebers (Sinusknoten) oder der elektrische Überleitung von den Vorhöfen auf die Herzhauptkammern gestört (AV-Knoten), kann sich die Herzfrequenz stark verlangsamen (Bradykardie) oder komplett über Sekunden aussetzen (Asystolie). Führt dies zu Symptomen wie Schwindel, Synkopen oder eine Leistungsschwäche, kann ein Herzschrittmacher die gestörte Funktion übernehmen und den Pulsschlag wieder normalisieren.
Es stehen verschiedene Herzschrittmachertypen zur Verfügung, welche je nach Art der zugrundeliegenden Herzrhythmusstörung eingesetzt werden:
- Einkammer-Herzschrittmacher: Eine Elektrode wird im rechten Vorhof oder in der rechten Herzhauptkammer eingesetzt.
- Zweikammer-Herzschrittmacher: Eine Elektrode wird im rechten Vorhof implantiert, eine weitere in der rechten Herzhauptkammer.
Operation: Die Implantation eines Herzschrittmachers ist ein relativ kleiner Eingriff. Unter örtlicher Betäubung setzt der Arzt einen ca. fünf Zentimeter langen Schnitt unterhalb des Schlüsselbeins zwischen dem Schulter- und Brustmuskel. Mittels Röntgenkontrolle werden dann über eine Schultervene je nach System eine oder zwei Elektroden zum Herzen vorgeführt. Wenn die optimale Lage ermittelt wurde, werden die Elektroden im Herzen fest verankert und dann mit dem Schrittmacher verbunden. Dann wird der Schrittmacher in eine kleine Hauttasche eingebettet und die Haut wird zugenäht. Die OP-Dauer beträgt etwa 45 Minuten bis 1,5 Stunden.
Nachsorge: Die Nachsorge kann z.B. beim niedergelassenen Kardiologen oder in der Klinik erfolgen. In der Regel erfolgt die erste Kontrolle ca. vier bis sechs Wochen nach der Operation, anschließend in der Regel alle sechs Monate. Im Rahmen der Nachsorge kann mithilfe eines gerätespezifischen Abfragekopfes das Gerät abgefragt, kontrolliert und gegebenenfalls individuell umprogrammiert werden.
Implantierbare Defibrillatoren (ICD)
Der ICD hat die Aufgabe, den Patienten vor dem plötzlichen Herztod durch ein schnelles Herzrasen aus den Herzkammern (Kammertachykardie oder Kammerflimmern) zu schützen. Diese Tachykardien können mit elektrischen Impulsen überstimuliert werden oder mittels Elektroschock beendet werden. Jedoch hat jeder ICD eine Schrittmacherfunktion und kann bei einem zu langsamen Herzschlag das Herz stimulieren. Grundsätzlich unterscheidet man hier zwischen einer sogenannten Primär- und Sekundärprophylaxe.
- Primärprophylaxe: Bis zur ICD-Implantation ist noch keine gefährliche Rhythmusstörung aufgetreten. Bei einer gegebenen Herzerkrankung besteht jedoch ein statistisch erhöhtes Risiko für einen plötzlichen Herztod.
- Sekundärprophylaxe: Der Patient hat bereits einen plötzlichen Herztod oder schnelle Kammertachykardien überstanden. Um einen weiteren zu verhindern wird ein ICD implantiert.
Operation: sehr ähnlich zum Herzschrittmacher (s. oben); Die Elektroden sind etwas dicker, die Geräte etwas größer, so dass diese bei schmalen Patienten teilweise nicht im Unterhautfettgewebe, sondern tiefer in einer Muskeltasche des Brustmuskels eingebettet werden. OP-Dauer ca. 45 Minuten bis 1,5 Stunden.
Nachsorge: Die Nachsorge kann z.B. beim niedergelassenen Kardiologen oder in der Klinik erfolgen. In der Regel erfolgt die erste Kontrolle ca. vier bis sechs Wochen nach der Operation, anschließend in der Regel alle sechs Monate. Im Rahmen der Nachsorge kann mithilfe eines gerätespezifischen Abfragekopfes das Gerät abgefragt, kontrolliert und gegebenenfalls individuell umprogrammiert werden.
Subkutane ICD
Dieses System erfüllt ebenfalls den Zweck, einen plötzlichen Herztod zu verhindern. Im Unterschied zum konventionellen, transvenösen ICD wird die Elektrode des S-ICD’s nicht über ein Gefäß ins Herz vorgebracht, sondern unter der Haut (subkutan) platziert; das Gerät sitzt im seitlichen Brustbereich (etwas Höhe 6. Rippe), die Elektrode meist links vom Brustbein.
Vorteil des Gerätes ist, dass mögliche Komplikationen des herkömmlichen ICD und der Elektroden (Sondenbrüche, -infektionen inkl. Herzklappenentzündungen) nicht oder mit weniger gravierenden Folgen auftreten können. Andererseits ermöglicht das Gerät (anders als die herkömmlichen Geräte) weder eine Überstimulation von Hauptkammertachykardien noch eine dauerhafte Schrittmacherfunktion.
Für dieses System sind folgende Betroffene geeignet:
- Junge Patienten mit einem erhöhten Risiko für einen plötzlichen Herztod und angeborenen Herzrhythmusstörungen (Brugada-Syndrom, Kurzes QT- Syndrom, CPVT, etc.)
- Gefäßverhältnisse, die eine konventionelle ICD-Implantation unmöglich machen
- Patienten mit stattgehabter Infektion/Defekt eines konventionellen ICD-Systems/nach Herzklappenentzündung
Operation: Der Eingriff wird in Vollnarkose durchgeführt. Der Hautschnitt wird links am seitlichen Brustkorb gesetzt. Dann wird eine Elektrode unter der Haut (subkutan) entlang der Rippe und seitlich am Brustbein hinauf getunnelt. Anschließend wird die Elektrode mit dem ICD-Aggregat verbunden und in einer Tasche zwischen dem großen Rückenmuskel und dem vorderen Brustwandmuskel eingebettet. OP-Dauer: ca. eine Stunde.
Nachsorge: Die Nachsorge kann in der Klinik erfolgen. Sollte eine Abfrage beim niedergelassenen gewünscht sein, empfiehlt sich vorher eine Nachfrage, ob das System in der Praxis abgefragt werden kann. In der Regel erfolgt die erste Kontrolle nach ca. vier bis sechs Wochen. Über einen gerätespezifischen Abfragekopf kann das Gerät abgefragt, kontrolliert und gegebenenfalls individuell umprogrammiert werden. Bei einem S-ICD empfehlen sich üblicherweise Kontrollen alle vier Monate.
Kardiale Resynchronisationstherapie (CRT)
Dieses System findet Anwendung in der Therapie der Herzinsuffizienz (Herzschwäche). Bei elektrischen Leitungsstörungen im Herzen (sogenannter Linksschenkelblock) kommt es zu einer ineffektiven und unharmonischen Kontraktion des Herzmuskels. Daraus resultiert bei schon vorgeschädigtem Herzen eine weitere Verminderung der Herzleistung. Ziel der kardialen Resynchronisationstherapie ist es nun, diese unharmonischen (asynchronen) Herzaktionen wieder zu harmonisieren (resynchronisieren) und dadurch die Herzleistung zu verbessern.
Wichtig ist, dass diese Maßnahme zusätzlich und nicht anstelle einer medikamentösen Herzschwächetherapie zu sehen ist. Patienten mit einer Herzschwäche ohne Linksschenkelblock profitieren von dieser Therapie leider meistens nicht.
Operation: Dieser Eingriff ist ähnlich dem einer Schrittmacher- oder ICD-Implantation (s. oben). Es werden üblicherweise aber insgesamt drei Elektroden eingesetzt: eine im rechten Vorhof, eine in der rechten Herzhauptkammer und eine auf die linke Herzhauptkammer. Das Auffinden einer guten Position für die linke Herzkammer kann schwierig sein und verlängert dadurch die OP-Dauer (zwei bis drei Stunden).
Nachsorge: Die Nachsorge kann z.B. beim niedergelassenen Kardiologen oder in der Klinik erfolgen. In der Regel erfolgt die erste Kontrolle ca. vier bis sechs Wochen nach der Operation, anschließend in der Regel alle drei bis vier Monate. Im Rahmen der Nachsorge kann mithilfe eines gerätespezifischen Abfragekopfes das Gerät abgefragt, kontrolliert und gegebenenfalls individuell umprogrammiert werden.
Life Vest
Der tragbare Defibrillator (LifeVest) bietet ebenfalls Schutz vor dem plötzlichen Herztod. Hierbei handelt es sich um eine tragbare Weste, die aus zwei Komponenten besteht: Einer Weste und einem Monitor. Beides wird unter der Kleidung getragen. Die LifeVest überwacht kontinuierlich den Herzrhythmus. Tritt eine lebensbedrohliche Herzrhythmusstörung auf (z.B. Kammertachykardie oder Kammerflimmern) gibt sie einen Behandlungsschock ab, um den normalen Herzrhythmus wiederherzustellen.
Anwendung findet das System bei Patienten, die mutmaßlich nur vorübergehend durch eine eingeschränkte Pumpkraft des Herzens (z.B. nach einem Herzinfarkt oder bei Herzmuskelschwäche, etc.) einem erhöhten Risiko für einen plötzlichen Herztod ausgesetzt sind. Durch die Weste gewinnt man Zeit, die Wirkung von Kathetereingriffen oder einer medikamentösen Therapie über einige Wochen abzuwarten; wenn sich die Herzleistungsschwäche nicht wiederholt, kann oft auf ein dauerhafte Defibrillatorimplantation verzichtet werden.
Kardiale Kontraktionsmodulation (CCM)
Die kardiale Kontraktilitätsmodulation (cardiac contractility modulation, CCM) kommt bei Patienten mit einer Herzschwäche bei schmalem QRS-Komplex infrage, also bei solchen, bei denen keine kardiale Resynchronisationstherapie (s. oben) infrage kommt dar und die trotz einer optimalen medikamentösen Therapie weiter unter der Herzschwäche (Luftnot, Schwindel, Leistungsschwäche) leiden. Dabei kann bei einigen Patienten eine deutliche Steigerung der Herzkraft sowie eine Verbesserung der körperlichen Belastbarkeit und der Lebensqualität erreicht werden. Langzeiterfahrungen mit mehr als zwei bis drei Jahren stehen allerdings noch aus.
Von einem speziellen Herzschrittmachersystem (Optimizer™ IVs, Impulse Dynamics, USA) werden dabei hochenergetische, elektrische Impulse erzeugt und über zwei transvenöse Herzschrittmacherelektroden ins Herz geleitet. Anders als bei regulären Herzschrittmachern rufen diese Impulse jedoch keine elektrische Antwort hervor (es entsteht kein Herzschlag), sondern führen zu Veränderungen auf zellulärer Ebene. Diese Systeme sind bisher nicht mit Herzschrittmacher- oder ICD-Funktionen ausgestattet, müssen also bei Patienten mit notwendigem ICD oder Herzschrittmacher zusätzlich eingebracht werden. Aufgrund des hohen Energieverbrauchs verfügt das Aggregat über eine wieder aufladbare Batterie, die einmal wöchentlich vom Patienten selbst aufgeladen wird.
Operation: sehr ähnlich zum Herzschrittmacher (s. oben); Das CCM-Aggregat wird meistens unter das rechte Schlüsselbein implantiert, da bei der Mehrzahl der Patienten auf der linken Seite bereits ein ICD-Aggregat vorhanden ist.
Nachsorge: Die Nachsorge wird primär in der Klinik erfolgen, zusammen mit einer eventuell notwendigen Schrittmacher-/ICD-Kontrolle. In der Regel erfolgt die erste Kontrolle ca. vier bis sechs Wochen nach der Operation, anschließend in der Regel alle drei bis vier Monate. Im Rahmen der Nachsorge kann mithilfe eines gerätespezifischen Abfragekopfes das Gerät abgefragt, kontrolliert und gegebenenfalls individuell umprogrammiert werden.